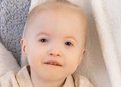
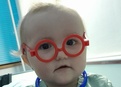
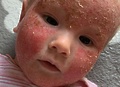
Иммунодефицитные состояния
Щербина А.Ю., Продеус А.П., Румянцев А.Г.
ФГУ ФНКЦ Детской гематологии, онкологии и иммунологии Росздрава
Российский государственный медицинский университет.
Слово «иммунитет» давно вошло в обиход не только врачей, но и не связанных с медициной людей: нам часто приходится слышать его в различных рекламных роликах, передачах по охране окружающей среды и т.д. Действительно, динамические изменения показателей иммунной системы происходят в ответ на различные состояния организма: инфекции, травмы, опухоли. Является ли это патологией? В большинстве случаев – нет, это нормальная реакция живого организма. Ведь основная функция иммунной системы – это борьба со всем чужеродным, будь то бактерия или опухолевая клетка. Однако в некоторых случаях изменения иммунной системы носят долгосрочный, патологический характер, такие состояния называются иммунодефицитными (ИДС). В зависимости от причин возникновения они разделяются на первичные и вторичные. Вторичные ИДС являются следствием серьезных внешних воздействий на организм: радиации, иммуносупрессивной химиотерапии, тяжелых инфекций (например, ВИЧ). По сравнению с первой группой, они встречаются намного чаще, однако, как правило, представляют меньше диагностических проблем, так как являются следствием уже известных факторов. Напротив, первичные иммунодефицитные состояния отличаются выраженной гиподиагностикой. Нередко больные с первичными ИДС не доживают до адекватного диагноза. В связи с этим в данном номере основное место отводится именно первичным нарушениям иммунитета.
Кроме того, проявления и тактика терапии вторичных ИДС во многом схожи с таковыми при первичных ИДС. В большинстве случаев основным как при первичных, так и при вторичных иммунодефицитах является инфекционный синдром. Однако важно помнить, что нарушение основной функции иммунной системы – распознавание своего и чужого – ведет к повышенной частоте аутоиммунных, опухолевых, и реже, аллергических заболеваний у больных с ИДС. Кроме того, дефекты иммунитета могут сопровождаться избыточной лимфопролиферацией и нарушением контроля воспаления.
Первичные иммунодефицитные состояния (ПИДС) относятся к группе тяжелых генетически детерминированных заболеваний, вызванных нарушением одного или нескольких иммунных механизмов защиты. Большинство этих состояний дебютирует в раннем детском возрасте повышенной склонностью к инфекционным заболеваниям. В настоящее время описано более 100 форм первичных ИДС. Частота встречаемости первичных иммунодефицитов в среднем составляет от 1:10000 человек. Ранняя диагностика и адекватная терапия ПИДС позволяет достичь стабильного общего состояния больных при большинстве этих заболеваний. Однако в связи с низкой настороженностью педиатров и врачей общей практики по отношению к первичным иммунодефицитам, отмечается неоправданно высокая инвалидизация и смертность пациентов с первичными ИДС, вызванная инфекционными и другими осложнениями.
Классификация первичных иммунодефицитных состояний.
Основываясь на имеющихся в настоящее время сведениях о механизмах развития первичных иммунодефицитов, международная классификация подразделяет эти заболевания на основные группы:
- С преимущественным поражением гуморального звена иммунитета,
- Комбинированные иммунодефициты (поражение клеточного и гуморального звена иммунитета),
- Дефекты системы фагоцитоза,
- Дефекты системы комплемента,
- Другие четко очерченные ИДС.
Более подробная детализация иммунодефицитных состояний выходит за рамки данной статьи, с полной классификацией можно ознакомится в специализированной литературе. Врачам общей практике нет необходимости досконально знать все нозологии ПИДС, однако важно иметь преставление о типичных проявлениях основных групп иммунодефицитов, общих закономерностях их диагностики и лечения.
Оценка иммунитета
Немаловажную роль в выявлении ПИДС играет правильная оценка анамнеза заболевания пациента, а также семейного анамнеза. Так, наличие частых, но нетяжело протекающих респираторных вирусных инфекций у детей дошкольного и младшего школьного возраста, как правило, не является достаточным основанием для предположения диагноза ПИДС. Однако частые инфекции у взрослых, наличие в анамнезе больного любого возраста повторных пневмоний, а также тяжелых инфекционных процессов, например, сепсис, гнойный менингит, остеомиелит, гнойные инфекции кожи, требуют проведения лабораторного иммунологического обследования. Наличие в семейном анамнезе смертей детей с клиникой инфекционного заболевания, а также наличие больных с диагнозом первичного ИДС также является фактором риска наличия ПИДС у обследуемого больного. Как было сказано выше, большинство ПИДС дебютируют в детском возрасте. Однако для многих нозологий первичных иммунодефицитов характерны «стертые формы», впервые проявляющиеся в подростковом и даже взрослом возрасте. Кроме того, для такого заболевания, как общая вариабельная иммунная недостаточность, достаточно характерны симптомы, впервые возникшие после 20 лет жизни. В связи с этим знание первичных иммунодефицитных состояний необходимо не только педиатрам, но и терапевтам, и врачам других специальностей.
Специализированное иммунологическое обследование проводится в специально оборудованных лабораториях. Однако простейшие лабораторные методы часто позволяют заподозрить ИДС на раннем этапе. Так, стойкая лимфопения (снижение числа лимфоцитов менее 1500 в мкл), особенно у детей младшего возраста, как правило, является признаком ИДС с поражением клеточного звена иммунитета. Значительное снижение гамма-фракции на электрофореграмме общего белка может свидетельствовать о нарушениях синтеза иммуноглобулинов.
Лабораторные методы выявления иммунодефицитных заболеваний включают оценку функционирования гуморального и клеточного звена иммунитета, системы комплемента, анализ других эффекторных механизмов, включая фагоцитоз и воспалительные реакции. Скрининговое исследование, помимо общего анализа крови, должно начинаться с исследования концентрации иммуноглобулинов IgM, IgG, IgA, с последующим количественным определением основных клеточных популяций лимфоцитов: Т-лимфоцитов, В-лимфоцитов, естественных киллеров. Сывороточная концентрация иммуноглобулинов, а также соотношение субпопуляций лимфоцитов зависят от возраста и клинического состояния больного, поэтому при оценке исследования необходимо учитывать возрастные нормы. При подозрении на дефект системы комплемента общая гемолитическая активность комплемента и индивидуальные компоненты комплемента как классического, так и альтернативного пути активации могут быть измерены иммунохимическими и функциональными методами. Оценка иммунного ответа может включать определение гуморального ответа на специфические вакцинальные антигены, например, дифтерийные и столбнячные токсины, убитые полио-антигены и т.д. Качественная оценка клеточного иммунитета, как правило, проводится in vitro, путем определения ответа лимфоцитов на митогены и специфические антигены. Оценка фагоцитоза проводится методом измерения степени редукции красителя нитро-синего тетразолия после специфического стимулирования клеток крови. Кроме того, активность фагоцитоза пропорциональна количеству погибших микроорганизмов или количеству выработанных радикалов кислорода, которое определяется с помощью хемилюминисценции. Дополнительно возможна in vitro оценка хемотаксиса, хемокинеза, а также продукции и секреции отдельных воспалительных цитокинов.
Для многих первичных иммунодефицитов описана хромосомная локализация дефектного гена, что создает основу для выявления генетических носителей и пренатальной диагностики ПИДС. В настоящее время пренатальная диагностика проводится на образцах фетальной крови, амниотических клетках или при биопсии ворсинок хориона.
Основные проявления первичных иммунодефицитных состояний.
Дефекты гуморального звена иммунитета
Дефекты с преимущественным поражением гуморального звена иммунитета составляют около 70% всех первичных ИДС и включают такие состояния, как общую вариабельную иммунную недостаточность (ОВИН), агаммаглобулинемию, селективный дефицит субклассов IgG, селективный дефицит IgA, а также некоторые другие (редкие) состояния. Лабораторный диагноз этих заболеваний основан на выявлении снижения или отсутствия одного или нескольких классов иммуноглобулинов в сыворотке при относительно нормальных показателях Т клеточного звена иммунитета. Число В лимфоцитов может быть нормальным (селективный дефицит IgA), сниженным (Общая вариабельная иммунная недостаточность), или нулевым (агаммаглобулинемия).
Наиболее характерными клиническими проявлениями гуморальных ИДС являются повторные, длительно текущие бронхо-легочные инфекции, а также инфекции кожи, кишечные и системные инфекции. Как правило, инфекционный синдром у этих больных дебютирует после 6-12 месяцев жизни, в период полного катаболизма материнского IgG. К наиболее часто выделяемым у этих больных возбудителям относятся инкапсулированные бактерии, реже выделяются другие виды бактерий, вирусы (особенно характерны энтеровирусные инфекции), грибы, микоплазмы и простейшие (Таблица 1). Легочные инфекции у больных с агаммаглобулинемией и ОВИН, не получающих заместительной терапии, часто приводят к формированию бронхоэктазов. В большинстве случаев гуморальных дефектов иммунитета вирусные инфекции протекают без особенностей в связи с нормальной функцией Т лимфоцитов. Часто у больных с гуморальными ИДС отмечается гипоплазия миндалин и лимфоузлов.
Селективный дефицит иммуноглобулина А
Значительное снижение сывороточного IgA отмечается в среднем с частотой 1 на 500-700 человек. Предположительно дефект является результатом отсутствия созревания IgA-продуцирующих лимфоцитов.
Критерием диагноза является снижение уровня сывороточного иммуноглобулина А ниже 7 мг/дл у детей старше 4 лет.
Наиболее характерными для селективного IgA-дефицита проявлениями являются инфекции ЛОР-органов и бронхолегочного тракта, а также аллергические и аутоиммунные состояния. Аллергические и аутоиммунные синдромы протекают без каких-либо особенностей, отличающих их от аналогичных состояний у лиц с нормальным количеством иммуноглобулина А в сыворотке. Инфекции бронхолегочного тракта протекают не тяжело и редко переходят в хронические формы. В целом заболевание имеет хороший прогноз.
Специфического метода лечения селективной недостаточности IgA не существует. Лечение аллергических и аутоиммунных заболеваний у пациентов с дефицитом IgA не отличается от таковых у больных без этого иммунодефицита. Существуют сообщения о купировании инфекционного синдрома у больных селективным дефицитом IgA на фоне заместительной терапии IgG-содержащими препаратами.
Агаммаглобулинемия
Агаммаглобулинемия является типичным и наиболее тяжелым заболеванием с селективным дефицитом продукции антител. Описанные генетические дефекты приводят к нарушению различных этапов созревания В лимфоцитов. Заболевание наследуется как Х-сцепленно (Болезнь Брутона), так и аутосомно-рецессивно.
Критерием диагноза являются снижениие концентрация сывороточного IgG менее 2 г/л при отсутствии IgA, IgM и циркулирующих В-лимфоцитов.
К основным клиническим проявлениям относятся повторные бактериальные инфекции респираторного тракта (бронхиты, пневмонии, синуситы, гнойные отиты), желудочно-кишечного тракта (энтероколиты), реже – кожи. Больные отличаются высокой чувствительностью к энтеровирусам, которые могут вызывать у них тяжелые энцефалиты. Природа нередко встречающегося склередемо- и дерматомиозитоподобного синдромов выяснена недостаточно, вероятнее всего они имеют энтеровирусную этиологию.
Общая вариабельная иммунная недостаточность
Термин «Общая вариабельная иммунная недостаточность» (ОВИН) используется для описания группы еще не дифференцированных синдромов. Все они характеризуются дефектом синтеза антител. Распространенность ОВИН варьирует от 1:50 000 до 1:200 000.
На данный момент ОВИН отнесена экспертами ВОЗ в группу иммунодефицитов c преимущественным нарушением антителогенеза, однако выявлено много данных, свидетельствующих о поражении Т-лимфоцитов. Таким образом, снижение продукции иммуноглобулинов вероятно связано с нарушением Т-клеточной регуляции их синтеза, то есть ОВИН в большей степени является комбинированным иммунодефицитом.
Диагноз ставится на основании значительного снижения трех, реже двух основных классов иммуноглобулинов (IgA, IgG, IgM) при нормальном или несколько сниженном числе циркулирующих В-клеток, а также нарушения специфического ответа. Перед постановкой диагноза необходимо исключить другие, хорошо известные, причины агаммаглобулинемии.
Инфекционные проявления ОВИН характерны для всей группы гуморальных дефектов. В этой группе больных часто встречается хроническая инфекция Giardia lamblia.
Среди больных с ОВИН необычно высока частота лимфоретикулярных и желудочно-кишечных злокачественных опухолей. В отличие от Х-сцепленной агаммаглобулинемии, у трети больных с ОВИН отмечается спленомегалия и/или диффузная лимфаденопатия. Встречаются неказеозные гранулемы, напоминающие таковые при саркоидозе. Кроме того, больные с ОВИН подвержены различным аутоиммунным нарушениям в виде гемоцитопений (пернициозной анемии, гемолитической анемии, тромбоцитопении, нейтропении), артрита и других.
Гипер-IgM синдром
Синдром представляет группу генетически разнородных заболеваний со сходными клиническими (и лабораторным) проявлениями. В основе синдрома лежат молекулярные нарушения пути взаимодействия рецептора CD40 на В-лимфоцитах с CD40-лигандом на Т-клетках, приводящие к нарушению переключения синтеза IgM на другие классы иммуноглобулинов. В 70% случаях заболевание наследуется Х-сцепленно, в остальных – аутосомно-рецессивно.
Основным критерием постановки диагноза Гипер IgM - синдрома является резкое снижение концентраций сывороточных IgG и IgA при нормальном или высоком содержании IgМ. Количество циркулирующих Т и В лимфоцитов как правило нормально. Тем не менее, при большинстве разновидностей заболевания отмечаются проявления, характерные для нарушения функции клеточного звена иммунитета (см. ниже).
Клинически Гипер-IgM синдром характеризуется повторными, иногда тяжело протекающими, инфекциями. На первом месте стоят поражения респираторного тракта, представленные синуситами, бронхитами и пневмониями, вызванные, в том числе, и условно-патогенной флорой (Pneumocyctis carinii). Серьезную проблему при гипер-IgM синдроме представляют гастроэнтерологические нарушения. Криптоспоридиоз является одной из причин неадекватного воспалительного ответа с развитием язвенного поражения желудочно-кишечного тракта и склерозирующего холангита, нередко приводящего к хронической печеночной недостаточности. У многих больных с этим синдромом выявляются те или иные гематологические нарушения (гемолитическая анемия, нейтропения, тромбоцитопения) и аутоиммунные расстройства, такие, как артрит, гломерулонефрит. Часто отмечается гиперплазия лимфоузлов и миндалин, нередко выявляется гепатоспленомегалия. Для этих больных характерны опухолевые заболевания.
Дефекты клеточного звена и комбинированные дефекты
Иммунодефициты с поражением Т-клеточного звена иммунитета разнообразны и варьируют по тяжести инфекционных проявлений и наличию сопутствующей неинфекционной патологии. Эти больные подвержены оппортунистическим инфекциям, вызванным простейшими, вирусами (Herpes simplex, Varicella zoster, Cytomegalovirus) или грибами. Часто эти больные страдают прогрессирующей пневмонией, вызванной вирусом Парагриппа 3 типа, ЦМВ или Pneumocystis carinii. Поражение той или иной функции Т-лимфоцитов, как правило, ведет к нарушению специфичности и гуморального ответа, так как функции В-лимфоцитов зависят от нормальной функции Т-лимфоцитов. В связи с этим у таких больных встречается также весь спектр возбудителей, характерных для гуморальных дефектов (см. Таблицу 3). К заболеваниям этой группы относятся Тяжелая комбинированная иммунная недостаточность (ТКИН), синдром ДиДжорджи, и другие.
Для большинства комбинированных ИДС, кроме инфекционного синдрома, характерны повышенная частота аутоиммунных заболеваний, в частности, нейтропений, тромбоцитопений, артритов, нефритов и других. Кроме того, эти больные с большей частотой подвержены онкологическим заболеваниям, особенно лимфоретикулярного происхождения.
Тяжелая комбинированная иммунная недостаточность
Наиболее серьезное из группы комбинированных дефектов, Тяжелая комбинированная иммунная недостаточность (ТКИН), проявляется в первые месяцы жизни. ТКИН представляет собой группу генетически разнородных заболеваний, в основе которых лежит нарушение созревания Т лимфоцитов с полным отсутствием их функции. В зависимости от генетического дефекта заболевание наследуется Х-сцепленно или аутосомно-рецессивно. Критериями диагноза для всех форм ТКИН являются: гипоплазия лимфоидной ткани, лимфопения, выраженное снижение CD3+ лимфоцитов, значительное снижение концентраций сывороточных иммуноглобулинов, раннее начало тяжелых инфекций. В зависимости от формы заболевания число В лимфоцитов варьирует от нулевых (Т-В-) до нормальных значений (Т-В+), однако во всех случаях их функция резко нарушена. При некоторых формах ТКИН определяется нормальное число НК лимфоцитов (НК+).
К типичным проявлениям относятся задержка физического развития, хронический понос, тяжелая молочница и грибковые поражения кожи, прогрессирующее поражение респираторного тракта, в виде пневмоциcтных пневмоний, вирусных бактериальных инфекций, пневмония и сепсис. При вакцинации БЦЖ у таких больных часто возникает местная или системная БЦЖ-инфекция. При рентгенографии грудной клетки таких больных должно настораживать отсутствие тени тимуса.
Синдром ДиДжорджи
В основе синдрома ДиДжорджи лежит достаточно частая хромосомная аберрация – делеция 22q11.2, приводящая к нарушению формирования органов, происходящих из 3 жаберной дуги (тимуса, паращитовидной железы, крупных сосудов и др). Ген, непосредственно отвечающий за развитие данного синдрома, не известен. Синдром характеризуется иммунодефицитом и типичным поражением различных органов. Заболевание варьирует по спектру и тяжести клинических проявлений и также может встречаться под названием кардиовелофациальный синдром, CATCH-синдром. Наиболее тяжелая форма синдрома ДиДжорджи характеризуется полным отсутствием тимуса, и как следствие, полным отсутствием Т лимфоцитов и нефункциональными В лимфоцитами. Заболевание протекает так же, как и вышеописанная ТКИН, однако частота «полного» синдрома ДиДжорджи невелика - 0.2 на 100 000 человек (для сравнения частота ТКИН 1.5 на 100 000 человек). Гораздо чаще встречаются менее тяжелые нарушения иммунитета, приводящие к развитию рецидивирующих синуситов, отитов, легочных инфекций. Для синдрома ДиДжорджи также характерны аутоиммунные проявления (цитопении, ревматоидный артрит, тиреоидит) и опухоли (как правило, лимфомы). К неиммунологическим дефектам синдрома относятся пороки сердца (тетрада Фалло, стеноз аорты, перегородочные дефекты, truncus arteriosus), патология неба (расщепление, подслизистое расщепление, раздвоение увули), особенности лицевого скелета (низко посаженные оттопыренные уши, антимонголоидный разрез глаз), позднее прорезывание и гипоплазия эмали зубов,скелетные аномалии (аномалии позвоночника, аномалии нижних конечностей), гипокальцемия, реже патология почек, патология сосудов сетчатки, дизгенезия передней камеры глаз, неврологическая патология (атрофия коры, гипоплазия мозжечка), отставание умственного развития. Эти признаки могут встречаться как изолированно, так и в комбинации друг с другом и иммунологическими дефектами. Лабораторно у больных с синдромом ДиДжорджи выявляется лимфопения различной степени со снижением Т лимфоцитов, нарушение их митогенного ответа, повышенное или нормальное число В лимфоцитов, различная степень снижения уровня иммуноглобулинов.
Другие четко очерченные ИДС
Синдром Вискотта-Олдрича
Синдром Вискотта-Олдрича (СВО) - это Х-сцепленное заболевание, характеризующееся комбинированным иммунодефицитом в сочетании с тромбоцитопенией и экземой. Заболевание является результатом мутации гена, кодирующего белок WASP, который принимает участие в полимеризации актина и формировании цитоскелета. Отсутствие белка WASP в лимфоцитах и тромбоцитах больных приводит к развитию тромбоцитопении, нарушению функций Т-клеток и регуляции синтеза антител. Диагноз типичных форм СВО можно предположить у больных мужского пола при наличии тромбоцитопении с уменьшением размера тромбоцитов в сочетании с экземой и частыми инфекционными заболеваниями бактериальной, реже вирусной и грибковой этиологии. Однако часто встречаются легкие формы заболевания, протекающие с тромбоцитопенией и геморрагическим синдромом разной степени выраженности, однако без выраженного инфекционного синдрома и/или аллергического анамнеза. В связи с этим молекулярно-генетическое исследование является необходимым для окончательного подтверждения диагноза.
Лабораторные изменения при СВО относительно неспецифичны и представлены лимфопенией, в основном за счет Т-лимфоцитов, снижением функциональной активности Т-клеток, нормальным или сниженным уровнем IgG, повышенным уровнем IgA и IgE, и сниженным IgM, нарушенной продукцией антител, особенно к полисахаридным антигенам.
Клинические проявления заболевания как правило дебютируют на первом году жизни. Геморрагический синдром в виде мелены, носовых кровотечений, кожной геморрагической сыпи, как правило имеется у всех больных на момент постановки диагноза. Атопические и инфекционные проявления зависят от тяжести течения заболевания. Для больных СВО характерно развитие аутоиммунных заболеваний, среди которых часто встречается аутоиммунная анемия, гломерулонефрит, колит, иммунная нейтропения. У больных с СВО повышен риск развития злокачественных новообразований лимфоретикулярного происхождения.
Атаксия-тельангиэктазия
Атаксия-тельангиэктазия (А-Т) (синдром Луи-Бар) - это синдром с аутосомно-рецессивным типом наследования, характеризующийся прогрессирующей мозжечковой атаксией, появлением мелких тельангиэктазий, особенно на бульбарных конъюнктивах и комбинированным иммунодефицитом. Мутации гена ATM, кодирующего белок, участвующий в репарации двухцепочечных разрывов ДНК и регуляции клеточного цикла.
Характерной лабораторной находкой при АТ является повышение альфафетопротеина. Иммунологические изменения неспецифические и включают снижение количества и функциональной активности Т-лимфоцитов, инверсию соотношения CD4+/CD8+, снижение или отсутствие IgA, IgG2, IgG4 и IgE, реже выявляются концентрации иммуноглобулинов, близкие к норме или дисиммуноглобулинемия в виде резкого снижения IgA, IgG, IgE и значительного повышения IgM. Клинические проявления могут существенно отличаться у разных больных. Прогрессирующая мозжечковая атаксия и тельангиэктазии присутствует у всех. Склонность к инфекциям колеблется от очень выраженной до весьма умеренной. Практически для всех больных характерна высокая частота развития злокачественных новообразований.
Синдром Ниймеген
Синдром Ниймеген характеризуется наличием у больных характерного фенотипа и иммунодефицита. В основе заболевания лежит мутация гена NBS1, кодирующего белок нибрин. Нибрин принимает участие в восстановлении двухнитевых разрывов ДНК. Для больных характерно нарушение функций Т-клеток. Концентрации сывороточных иммуноглобулинов у больных с синдромом Ниймеген колеблются от субнормальных значений до агаммаглобулинемии. Клинически у большинства больных отмечаются различные инфекции, характерные для комбинированных дефектов иммунитета. Злокачественные новообразования встречаются с очень высокой частотой.
Аутоиммунный лимфопролиферативный синдром
В основе аутоиммунного лимфопролиферативного синдрома (АЛПС) лежат первичные дефекты апоптоза лимфоцитов, что приводит к потере контроля над пролиферацией лимфоидных клеток и негативной селекцией лимфоцитов. Заболевание имеет полигенную природу, и связанно с нарушением функции белков Fas-опосредованного пути апоптоза. Все известные на настоящий момент дефекты наследуются аутосомно-рецессивно. Диагноз АЛПС можно предположить при наличии у больного поликлональной гипериммуноглобулинемии (повышены один или несколько классов сывороточных иммуноглобулинов), выраженного увеличения лимфоузлов, гепатоспленомегалии (при исключении других, в т.ч. онкологических причин этих симптомов). Характерным лабораторным признаком АЛПС является наличие двойных негативных CD3+CD4-CD8- лимфоцитов, в норме отсутствующих в периферической крови. Однако подтверждением диагноза является выявление дефекта апоптоза in vitro.
Основными клиническими проявлениями АЛПС являются: лимфаденопатия, гепатоспленомегалия, аутоиммунные гемоцитопении в виде гемолитической анемии и/или агранулоцитоза и/или тромбоцитопении, и другие аутоиммунные расстройства (неспецифический язвенный колит, артрит, узловатая эритема, сиалоаденит и др.). У большинства больных выявляются аутоантитела к различным клеткам и тканям организма.
Синдром гипериммуноглобулинемии Е
Молекулярная природа синдрома гипериммуноглобулинемии Е (гипер-IgE синдром) до настоящего времени не изучена. Тип наследования, вероятно, аутосомно-кодоминантный. Гипер-IgE синдром характеризуется повторными (обычно стафилококковыми) абсцессами подкожной клетчатки, легких (приводящих к образованию пневмоцеле), паренхиматозных органов, а также аномалиями скелета, грубыми чертами лица (гипертелоризм, широкая переносица), дерматитом, повышенной склонностью к переломам костей. Иммунологический механизм заболевания не выяснен. Для заболевания характерны эозинофилия, крайне высокий уровень сывороточного IgE, нарушение хемотаксиса нейтрофилов.
Дефекты системы фагоцитоза
Дефекты продукции и функции клеток фагоцитарной системы предрасполагают к развитию пиогенных и грибковых инфекций, а также к инфекциям, вызванным внутриклеточными микроорганизмами. К наиболее частым возбудителям у этих больных относятся Pseudomonas, Serratia marcescans, Staphylococcus aureus, a также грибы рода Aspergillus и Candida. К этой группе заболеваний относятся такие состояния, как хроническая гранулематозная болезнь (ХГБ), дефицит молекул адгезии лимфоцитов, синдром Грисцелли и другие. Легочные инфекции отмечаются у этих больных наиболее часто. К другим характерным инфекционным проявлениям относятся гнойный лимфаденит, подкожные абсцессы, остеомиелит и сепсис.
Дефекты системы фагоцитоза не связаны с повышенным риском развития неинфекционной патологии, например опухолей или аутоиммунных заболеваний.
Хроническая гранулематозная болезнь
Хроническая гранулематозная болезнь (ХГБ) является типичным заболеванием данной группы. Выявлено четыре молекулярных дефекта, лежащих в основе ХГБ. В зависимости от генетического дефекта заболевание наследуется Х-сцепленно или аутосомно-рецессивно. Все молекулярные дефекты вызывают дисфункцию фермента НАДФ-оксидазы, что ведет к нарушению образования кислородных радикалов в нейтрофилах и внутриклеточного киллинга. Для больных ХГБ характерны инфекции, вызванные в основном каталаза-продуцирующими микроорганизмами (стафилококки, кишечная палочка, сальмонелла, нокардия), с поражением легких, кожи и подкожной клетчатки, лимфатических узлов, печени и с формированием воспалительных гранулем и абсцессов. У 10-17% больных отмечаются обструкция мочевыводящих путей, энтериты и колиты. Большую опасность для больных с ХГБ представляют инфекции, вызванные грибами, отличными от рода Candida (например, аспергиллез). Диагноз ХГБ подтверждается выявлением снижения продукции перекисных радикалов при оценке с помощью методов люминол-зависимой хемилюминисценции и НСТ-теста, а также выявлением характерных мутаций.
Дефекты системы комплемента
Дефекты системы комплемента являются наиболее редкой разновидностью ПИДС (1-3%). Описаны наследственные дефекты практически всех компонентов комплемента. Наиболее часто встречается дефицит С2 компонента. Дефекты ранних фракций комплемента (С1-С4) сопровождаются высокой частотой аутоиммунных заболеваний, в том числе системной красной волчанки. Дефекты терминальных компонентов (С5-С9) предрасполагают к развитию тяжелых инфекций, вызванных представителями рода Neisseria. Дефицит С3 компонента часто по клиническим проявлениям напоминает гуморальные ПИДС и сопровождается тяжелыми рецидивирующими инфекциями: пневмония, менингит, перитонит. С другой стороны, некоторые больные с дефицитом С2, С4, С9 могут не иметь никаких клинических проявлений. Универсальной терапии этих состояний не существует, она зависит от конкретных клинических проявлений. Особняком в этой группе заболеваний стоит врожденный ангионевротический отек, вызванный дефицитом С1-ингибитора.
Ангионевротический отек
В основе заболевания лежит снижение концентрации и/или функции С1-ингибитора практически единственно ингибитора системы комплемента, а также кинин-калликреиновой системы. Заболевание наследуется аутосомно-кодоминантно. Частота инфекционных проявлений у этих больных может быть несколько повышена, однако основным симптомом заболевания являются рецидивирующие отеки конечностей, брюшной полости, лица и гортани. Отеки могут возникать самопроизвольно, а также провоцироваться стрессом, минимальной травмой, инфекцией. В патогенезе отеков лежит образование вазоактивных веществ, отличных от гистамина, в связи с чем терапия антигистаминными препаратами и глюкокортикостероидами при этом состоянии не эффективна.
Таблица 1. Основные возбудители и подходы к терапии инфекционных проявлений ПИДС.
Группа иммунодефицитов
Наиболее частые возбудители
Терапевтические подходы
Гуморальные дефекты
Инкапсулированные бактерии (Str.pneumoniae, Staph.aureus, H.influenzae, N.meningitidis); P.aeruginosa, Campilobacter sp., Энтеровирусы, Рота-вирусы, G.lamblia, Cryptosporidium sp., Pneumocystis carinii, Ureaplasma urealyticum, Mycoplasma pneumoniae
- Внутривенный иммуноглобулин (800-100 мг/кг)
- Проведение посева до начала а/б терапии.
- Хирургический дренаж абсцессов.
- Антимикробная терапия с учетом чувствительности (по возможности)
Клеточные и комбинированные дефекты
Инкапсулированные бактерии (Str.pneumoniae Staph.aureus, H.influenzae), факультатаивные внутриклеточные организмы (Myc.tuberculosis, другие виды Mycobacterium, Lysteria monocytogenes); E.coli, P.aeruginosa, Enterobacter sp.; Klebsiella sp.; Serratia marcescens; Salmonella sp., Nocardia sp.; Pneumocystis carinii, вирусы (ЦМВ, ВПГ, ЭБВ, Ротавирусы, Аденовирусы, Энтеровирусы, РС-вирус, вирус кори, вирус парагриппа), простейшие (Toxoplasma gondii, Cryptosporidium sp.); грибы (Candida sp., Cryptococcus neoformans, Histoplasma capsulatum)
- Проведение посева до начала а/б терапии.
- Хирургический дренаж абсцессов.
- Антимикробная терапия с учетом чувствительности (по возможности).
- Раннее применение противовирусных препаратов
- Возможно применение местных и неадсорбируемых антимикробных препаратов.
- Запрещение вакцинации живыми вакцинами
- Профилактическое применение триметоприма-сульфаметаксозола для профилактики P. carinii)
Дефекты фагоцитоза
Staph.aureus, E.coli, Aspergillus sp., Salmonella sp., Klebsiella sp., Serratia marcescens, Pseudomonas sp., Enterobacter sp., Proteus sp., Nocardia sp., Proteus sp., Candida sp., P.carinii, Mycobacterium sp., Actinomyces sp.
- Профилактика инфекций путем максимальной иммунизации и исключения контактов с источниками инфекции.
- Профилактическая антибактериальная терапия.
- Проведение посева до начала а/б терапии.
- Раннее назначение а/б и противогрибковой парэнтеральной терапии
- Хирургическая резекция очагов инфекции
Дефекты системы комплемента
Инкапсулированные бактерии (Str.pneumoniae Staph.aureus, H.influenzae), Neiseria sp.
- Вакцинация.
- При некоторых формах – ранняя антибактериальная терапия.
Основные подходы к терапии и ведение больных с первичными иммунодефицитными состояниями.
Основными задачами ведения больных с ПИДС являются:
1) Коррекция имеющегося иммунологического дефекта
2) Профилактика и/или адекватная терапия инфекционных проявлений
3) Раннее выявление и терапия неинфекционных проявлений
4) Социальная адаптация детей с ПИДС.
Несмотря на то, что больные с первичными иммунодефицитом проходят специальное обследование и терапию в специализированных стационарах, основная роль в выявлении этих состояний принадлежит врачам первичного звена. В связи с этим Европейское и Панамериканское общества иммунодефицитов (ESID PAGID) предложили использовать следующие критерии риска ПИДС (Табл.2). При наличии одного или нескольких из этих признаков больному показано проведение иммунологического обследования и консультация специалиста-иммунолога.
12 НАСТОРАЖИВАЮЩИХ ПРИЗНАКОВ ПЕРВИЧНОГО ИММУНОДЕФИЦИТА У ДЕТЕЙ И ВЗРОСЛЫХ